هنگامی که بدن ما آلوده می شود، پاسخ های ایمنی مختلفی ایجاد شده که با آزاد شدن گرانولوسیت ها شروع می شود، گلبول های سفید حاوی آنزیم های خاصی است که حدود نیمی یا بیشتر از کل گلبول های سفید خون انسان را تشکیل می دهند.
به گزارش سیناپرس، نوتروفیلها همچنین گرانولوسیتهایی هستند که با باکتریها و قارچ های مهاجم مبارزه می کنند و اغلب تحمل آنها صفر است. با این حال، گاهی اوقات، یک رویکرد متعادل و کمتر تهاجمی در ارائه یک درمان ایجاد می شود.
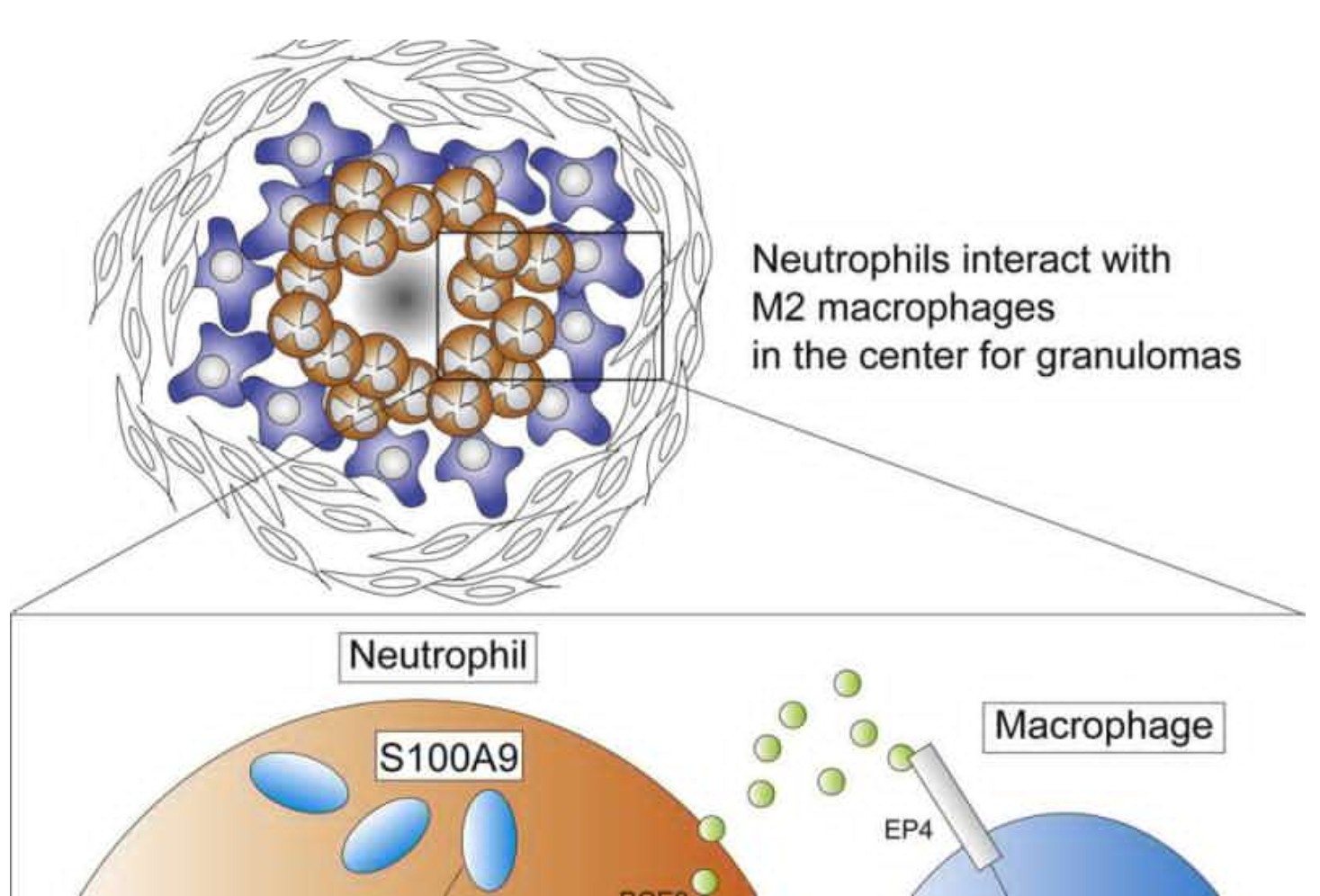
اکنون، تیمی از محققان دانشگاه کیوتو به این نتیجه رسیده اند که نوتروفیل ها ماکروفاژهای ضد التهابی یا M2 را در اعماق هسته این گرانولوسیت ها القا می کنند.
در مطالعات قبلی، ماکروفاژهای التهابی مزمن دارای پتانسیل پلاریزه شدن یا تمایز به دو نسخه متضاد بودند که شامل انواع پیش التهابی یا M1 و ضد التهابی یا M2 می شود. اینها یک تعادل M1-M2 را تشکیل می دهند که شدت التهاب و سلامت بافت یا هموستاز را تنظیم می کند.
 این طبیعت دوگانه یا قطبی شدن نشان می دهد که چگونه M2 می تواند به M1 یا حتی M0 یعنی حالت غیر التهابی یا پایدار، بازگردد. این تیم تحقیقاتی ساختارهای کروی متراکم گرانولوم ها را در حیوانات، به ویژه در ریه ها بررسی کرد.
این طبیعت دوگانه یا قطبی شدن نشان می دهد که چگونه M2 می تواند به M1 یا حتی M0 یعنی حالت غیر التهابی یا پایدار، بازگردد. این تیم تحقیقاتی ساختارهای کروی متراکم گرانولوم ها را در حیوانات، به ویژه در ریه ها بررسی کرد.
تاتسواکی میزوتانی (Tatsuaki Mizutani) پژوهشگر اول این مطالعات می گوید: میکروها و سلول های سرطانی ممکن است این ریزمحیط را برای کمک به بقای خود دستکاری کنند. اختلالات مرتبط با گرانولوم انسانی از جمله سل یکی از مشخصه های بیماری های التهابی مزمن است. میزوتانی معتقد است که نتایجی که تیم او از سل به دست آوردند ممکن است برای تومورها نیز اعمال شود.
مطالعات قبلی نشان داد: فعل و انفعالات بین سلولی در گرانولوم ها باعث ایجاد پاسخ های التهابی موثر در برابر پاتوژن ها یا آلاینده ها می شود، اما التهاب مزمن مانند سل و تومورها، در دوره های زمانی طولانی ادامه می یابد.
برای آزمایش چگونگی پیش بینی توسعه تومور، تیم پژوهشی میزوتانی یک مدل گرانولوم ریه در خوکچه هندی ایجاد کرد که تجمع خاص نوتروفیل S100A9 یا A9 را در عمق هسته های گرانولوم نشان داد.
میزوتانی که تیمش اکنون در حال بررسی این است که آیا طبیعت چند منظوره A9 را در ریزمحیط تومور ضد تومورزا کند یا خیر، می گوید: آنچه جالب است این است که هم اثرات التهابی و هم اثرات ضدالتهابی A9 در موشهای دارای کمبود A9 گزارش شده است. میزوتانی می گوید: درک ما از چگونگی شکل گیری یک ریزمحیط مجاز در تومورها ممکن است برای توسعه مؤثر داروی سرطان به کار رود.
شرح کامل این مقاله تحقیقاتی در مجله iScience منتشر شده است.










